百暨基因自体CLL-1 CAR-T再申临床成功获批,OR超80%
2022-12-30 00:00 百暨基因
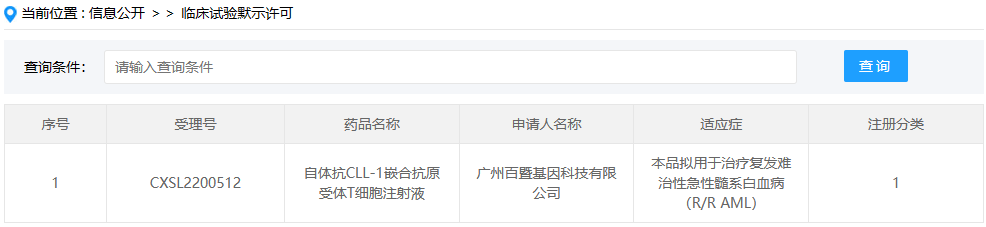
2022年12月30日,CDE官网-临床试验默示许可公示,广州百暨基因科技有限公司“自体抗CLL-1嵌合抗原受体T细胞注射液”(Anti-CLL1 CAR-T,BG1805)的IND申请获批,拟用于治疗复发难治性急性髓系白血病(R/R AML)。该药物在去年8月和今年10月先后获得了FDA和EMA授予的孤儿药认定,用于AML的治疗。
AML代表了一组异质性的骨髓性恶性肿瘤,普遍发生于各个年龄阶段,是成年人最常见的急性白血病,具有原发性、难治性、易复发性及治疗致死性,是一种致死率较高的疾病。在过去的几十年, AML的治疗一直属于世界性难题,虽然近几年个体化治疗、替代治疗等方式取得了一定的进步,但目前化疗仍是主要治疗方式,70%左右获得缓解的患者最终将复发并演变为难治性白血病,导致治疗失败而死亡。
鉴于AML的异质性以及随疾病进展而变化的特点,寻找合适的靶点尤为重要。CLL-1在儿童AML细胞和白血病干细胞LSCs上高表达,几乎不表达于正常造血细胞,因此是一种极具药物开发潜力的靶点之一。
百暨基因自主研发的BG1805具有三个优势:抗体具有高特异性、高亲和力;持久、高效的癌细胞杀伤能力;安全性良好,具有可成药性,成功实现了在提高CAR-T靶向性、治疗疾病的同时不会对造血系统、免疫系统造成严重破坏。
BG1805是由百暨基因自主研发、拥有核心专利技术,精准靶向CLL1的细胞治疗药物,目前正在一项由研究者发起的1期临床试验(IIT),主要用于评估其安全性和有效性。初步试验结果在2021年的ASCO年会上公布,BG1805治疗R/R AML患者有效且毒性可控,显示了出色的临床治疗潜力。
该研究共入组了11名R/R AML的儿童患者。数据显示,在接受给药后后,CAR-T细胞患儿体内快速、高效地扩增;总缓解率(OR)高达81.8%(9/11),总疾病控制率(DCR)高达90.9%(10/11),10名患者均在一个月内即对BG1805产生积极响应。
此外,根据百暨基因披露的消息可知,该新药上市后,按国内每人100万元人民币治疗费用及每年新增2-4万患者估算,相比国外每人约30~45万美元治疗费用,每人可节省约100万人民币,共节省约400亿元人民币,将有效提高CAR-T药物的可及性。对打破国内AML患者无特效药,国外进口药、高价药垄断国内市场的格局具有重要意义。
百暨基因管线涉及白血病、淋巴瘤等造血系统肿瘤以及多种实体瘤,除了筛选、设计,开发新靶点及功能增强的CAR-T治疗产品外,公司为商业化大规模生产CAR-T进行工艺创新,以增强产品的安全性,有效性和一致性,并进一步节约成本。
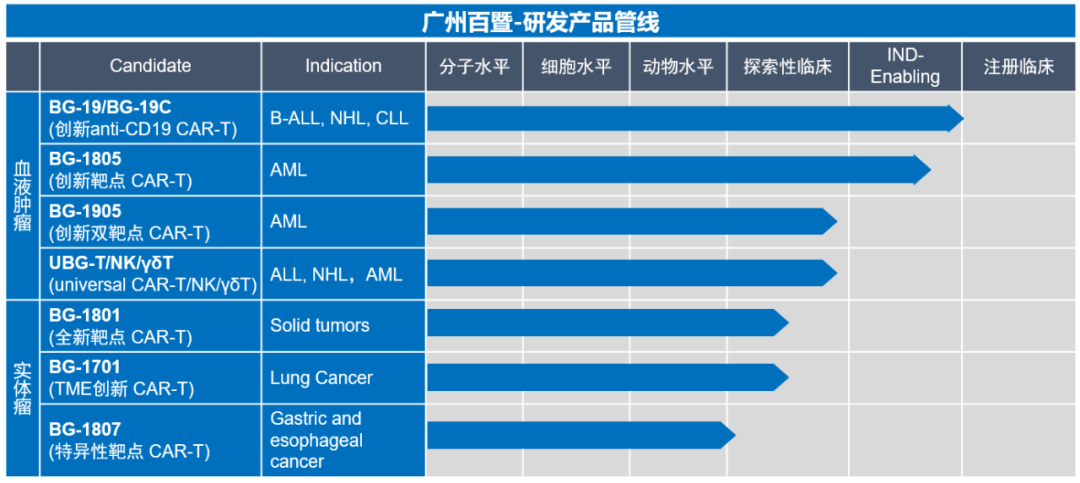
▲ 百暨基因管线 图源:公司官网
据悉,这是此款CAR-T产品第二次申报,并且成功获批临床。在今年6月,该产品进行首次申报,时隔四个月后,百暨基因重整旗鼓,10月份申请获得受理后成功在今天获批临床,期待在未来临床试验能够顺利推进,成功惠及更多患者。


