Nature子刊:新一代CAR-T“开关”,让细胞疗法更安全
2021-12-06 00:00 医麦客
Nature子刊:新一代CAR-T“开关”,让细胞疗法更安全丨医麦猛爆料
2021年12月6日/医麦客新闻 eMedClub News/--CAR-T疗法是治疗复发/难治性B细胞恶性肿瘤和骨髓瘤的有效方法,并且正在向实体瘤领域进军。然而,CAR-T细胞疗法的安全性问题,如细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS),仍然令人担忧。
2021年11月10日,发表在Nature Scientific Reports上的一篇文章描述了一种可控的CAR-T细胞系统(TetCAR)。通过使用获得许可和广泛使用的抗生素二甲胺四环素,能够可逆地抑制程序性T细胞的活性。

对CAR-T疗法安全性的探索
与小分子或蛋白质疗法不同的是,CAR-T细胞移植和扩增,因此毒性可能是进行性和暴发性的。因此,基因编码的安全机制已经被开发出来,它可以在给药后控制CAR-T细胞的活性。例如,已经描述了几种自杀基因,它们可以面临毒性时选择性地破坏CAR-T细胞。然而这种策略会使CAR-T细胞永久失活,可能会导致疾病复发。
后续研究的目标旨在开发能够对CAR-T活性进行滴定和可逆控制的CARS。在这个家族中有分裂的CAR“on”设计,需要二聚体才能将靶结合结构域连接到信号转导结构域。在这种情况下,二聚化药物的退出会导致CAR失活。这种方法的一个局限性是依赖于长期给药的可变药代动力学和生物分布,以及与这些药物持续给药要求相关的不便。
一种更方便的方法是分离的CAR“off”设计,即通过小分子药物破坏靶标结合域和信号域之间的相互作用。使用这种方法,CAR在注射小分子后被灭活。在这里,一种合成的异二聚体CAR被设计出来,它可以被添加的一种小分子药物破坏。然而,该系统的一个局限性是需要一种新的、临床未测试的小分子,这限制了这种方法的临床转化的方便性。
据这篇文章的作者描述,他们试图开发一种分离的CAR“off”系统,在该系统中,CAR可以通过添加一种广泛可用的小分子二甲胺四环素来解离。为此,他们利用了四环素抑制蛋白(TetRB)和四环素肽模拟物TIP之间的相互作用,创建了可以在暴露于二甲胺四环素(TetCAR)后关闭的分裂CAR。迭代优化确定了一种包含Fab结合结构域和CD28核内结构域的TetCAR格式。在没有二甲胺四环素的情况下,这种形式保持了有效的活性,具有可逆的二甲胺四环素诱导的抑制作用。
二甲胺四环素的调控应用
二甲胺四环素是理想的小分子药物。二甲胺四环素是一种经FDA批准的半合成四环素衍生物,临床使用已超过30年。口服给药耐受性好,可快速吸收,2小时后血清浓度达到峰值,生物利用度几乎完全。二甲胺四环素还有一个额外的好处,它不同于其他类似物,如四环素,它是一种高度亲脂分子,可以很容易地穿过血脑屏障,导致脑脊液和中枢神经系统的高水平。由于CAR相关神经毒性/ICANS的频率高,这对于CAR安全开关的使用具有潜在的重要性。
为了创造一种二甲胺四环素抑制的裂解型CAR,文章中利用了二甲胺四环素抑制蛋白B (TetRB)和四环素短肽模拟表位TIP的结合。文章中构建了一个分裂的CAR,其中抗原结合结构域包含一个细胞内的TetRB结构域,而信号传导结构域表达为一个具有氨基末端TIP序列的单独蛋白质。假设这两种蛋白质会组装,但与TIP相比,TetRB和二甲胺四环素之间更高的亲和力将允许这种蛋白-蛋白相互作用的诱导破坏。最初的设计显示,二甲胺四环素有效地取代了这个结构域,并抑制了TetCAR转导细胞的功能。然而,通过细胞因子分泌测定的完整效应器功能明显低于整体对照组。
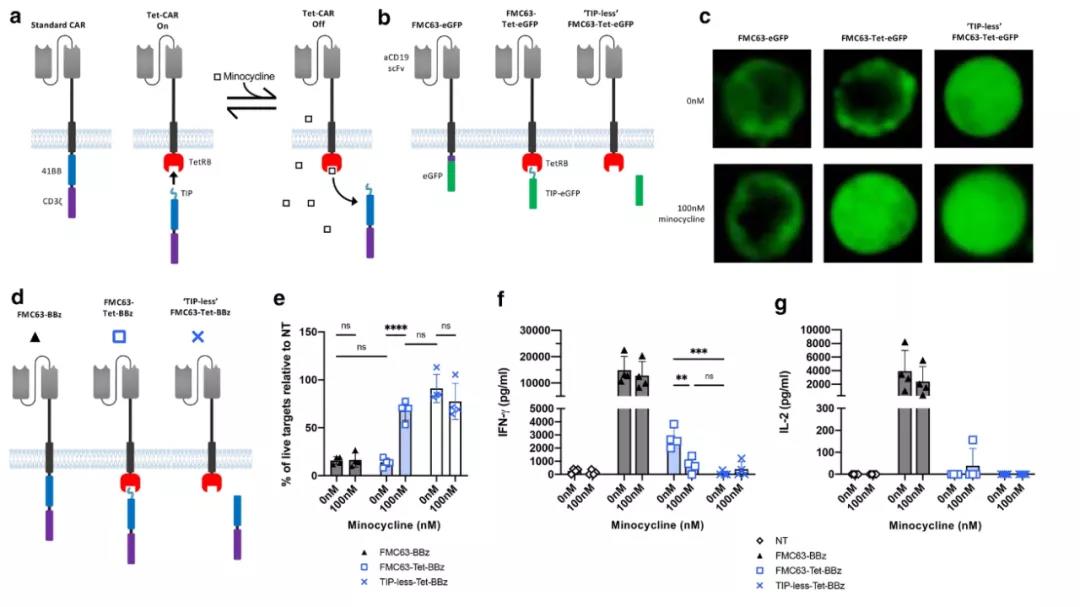
▲ 分裂的CAR通过TetRB和TIP的相互作用结合,并在加入二甲胺四环素后分离
文章中对TetCAR功能进行了几次实验性的修改。一个成功的修改是将TetCAR重新格式化为Fab格式。这种形式可能通过提高稳定性来改善CAR功能,这可以通过增加表面CAR染色得到证明。
▲ TetCAR表面转达和信号转导的优化
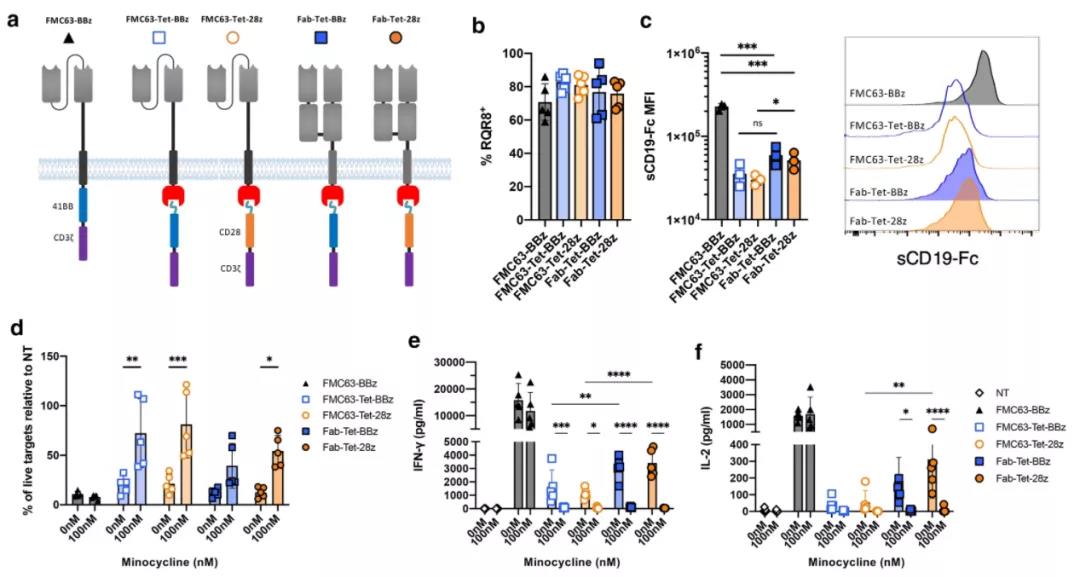
进一步成功的修饰是在抗原识别成分中加入共刺激域。这种膜近端的CD28结构能够匹配CAR对高CD19密度靶点的细胞因子分泌和增殖。膜近端共刺激也是其他分体式CAR方法的特点,因此可能是跨所有系统的需求。
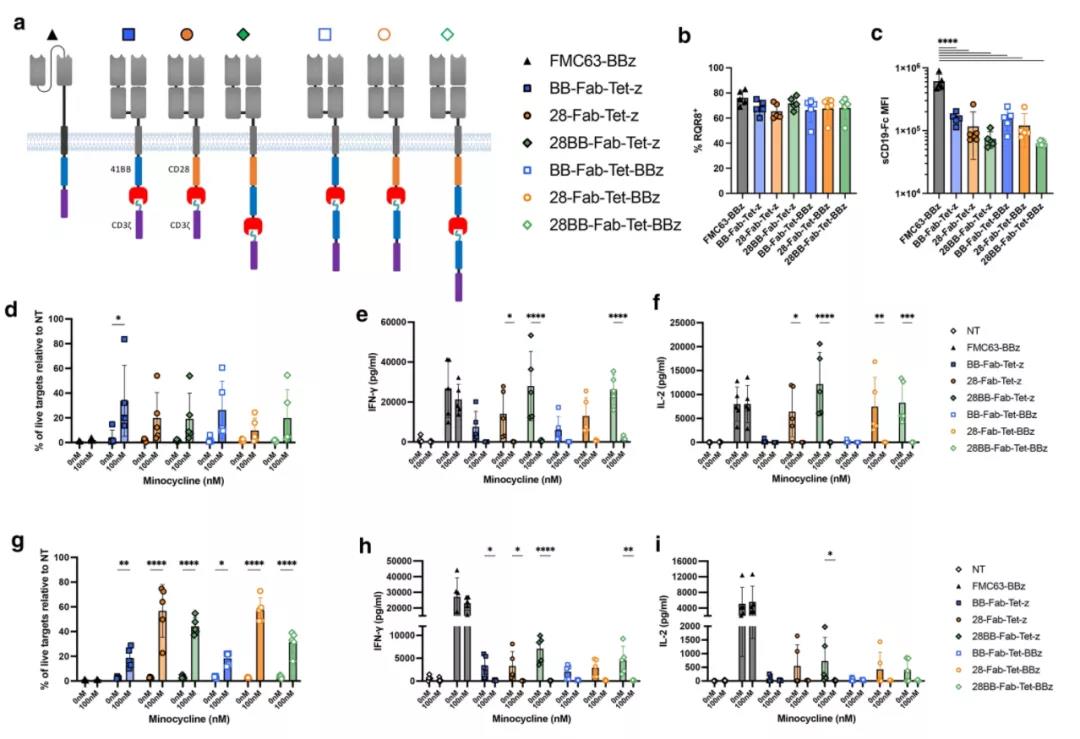
▲ 结构域位置的重构增强了TetCAR的功能
实验结果表明,添加二甲胺四环素可降低细胞毒性,并将细胞因子分泌和增殖降低到背景水平。二甲胺四环素能够迅速取代信号域,在不到3小时内导致IL-2分泌的功能性抑制。这种抑制是可逆的,并且依赖于剂量,能够在临床相关剂量范围内抑制CAR信号。
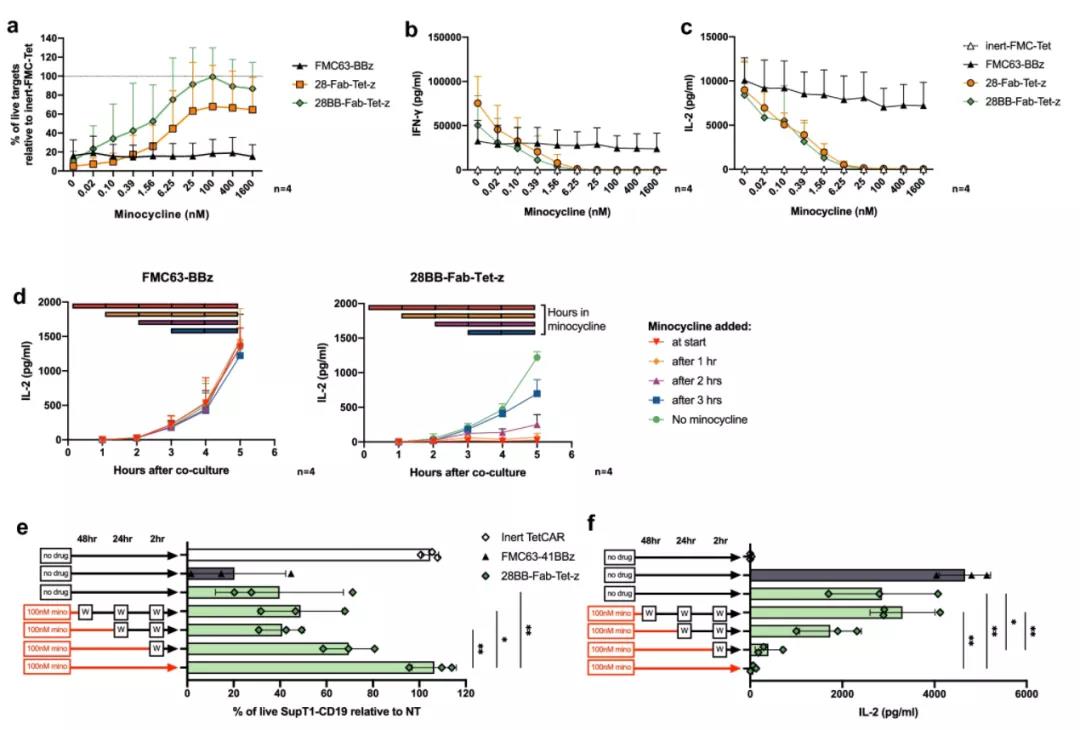
▲ TetCAR的活性对二甲胺四环素有剂量依赖性反应
TetCAR的一个缺点是,其结合成分TetRB来自细菌,可能是免疫原性的。值得注意的是,TetRB(和TIP)是细胞内的,因此不太可能成为体液免疫的靶点。有人试图降低TetR蛋白显性表位的免疫原性,但这导致了对亚显性表位的免疫应答,提示T细胞对TetRB的免疫可能是不可避免的。然而,越来越多的人使用同种异体方法,HLA被阻断或者在免疫抑制严重的情况下给予完全不匹配的细胞或allo-aggressive方法,可能使细胞排斥变得毫无意义。未来的工作还将集中在解决TetRB的免疫原性,同时保留二甲胺四环素作为小分子的好处,用其他二甲胺四环素的非免疫原性结合物替代TetRB。
据文章的作者介绍,他们已经生成了一个“off”开关CAR,在这个CAR中,CD3ζ信号域的剂量依赖性位移可以快速、稳定、可逆地降低活性。与其他类似方法相比,该系统的主要优点是它使用了一种简单、广为人知、FDA批准的抗生素,具有良好的药效学和血脑屏障穿透性。该系统可诱导针对高抗原密度靶点的有效杀伤、细胞因子分泌和增殖,同时在临床相关的二甲胺四环素剂量下保持有效的抑制作用。由于对CAR信号的抑制是快速和可逆的,这将允许在发生CAR介导的毒性事件中给患者使用二甲胺四环素,然后在毒性消退时将二甲胺四环素去除,以恢复CAR功能。
本文所描述的方法对于靶向新靶点的CARs,特别是那些在健康组织中低表达的CARs,或者对于CD19恶性肿瘤中未来的异体治疗方法都是非常有用的。



