CAR-NK细胞疗法的研究进展与挑战丨医麦新观察
2021-07-12 00:00 医麦客
2021年7月12日/医麦客新闻 eMedClub News/--最近几年,肿瘤免疫细胞疗法发展迅速,尤其是CAR-T细胞,已经有五款CAR-T细胞疗法产品获得美国FDA批准上市。国内也迎来了第一款CAR-T细胞产品的上市。
NK细胞的安全性及其抗肿瘤潜力,使它们成为实施CAR技术的有希望的细胞类型,可将其细胞毒性潜力重定向至特定靶标。目前,CAR-NK细胞的免疫疗法研究成为越来越多研究者的选择方向。
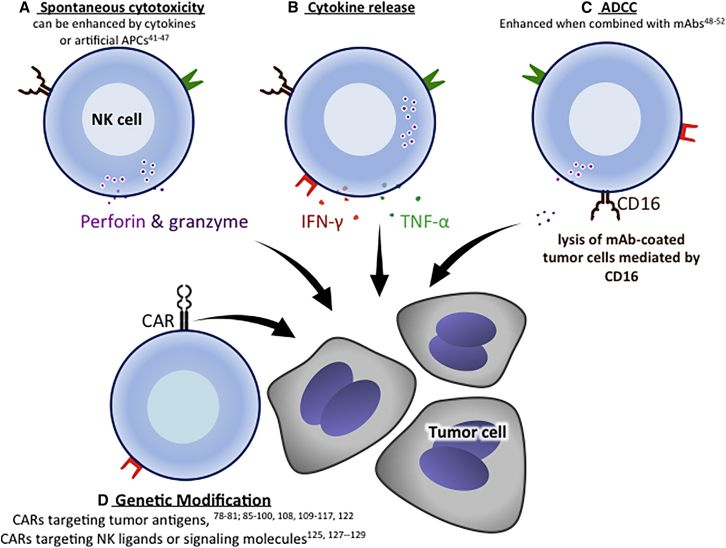
▲ NK细胞介导的肿瘤细胞毒性机制
NK细胞来源非常广泛,比如外周血、脐带血、胚胎干细胞、人类诱导多能干细胞和NK细胞系,不同来源的NK细胞有着各自的优势和缺陷。由于NK细胞可以经历的细胞分裂数量有限,很难扩增为输注所需的大量细胞。因此,研究者们逐步使用NK细胞系(如NK-92、YTS、KHYG-1等)代替从脐带或外周血获得的原代NK细胞进行了研究。
CAR-NK细胞的研究进展
在血液系统肿瘤中,目前研究较多的为CD19-CAR-NK细胞和CD33-CAR-NK细胞。
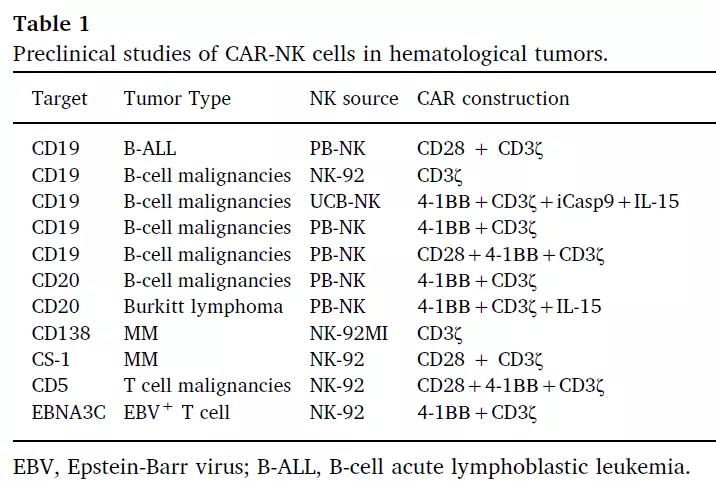
▲ CAR-NK细胞在血液瘤中的临床前研究
1.急性白血病
CAR-T细胞治疗急性淋巴细胞白血病(ALL)已显示出显著临床疗效,但该疗法对急性髓系白血病(AML)疗效不佳。从理论上讲,CAR-NK细胞比CAR-T细胞具有更有利的毒性,特别是在避免CRS等副作用方面。然而,这方面的临床数据尚无报道。
Xiaowen Tang等评估了CD33-CAR-NK细胞在复发和难治性AML患者中的安全性。该研究共入组3例患者,采用第二代CAR,结果显示在5x109个细胞的输注剂量下,没有明显的不良反应,并且与CAR-T细胞相比,CAR-NK-92细胞的成本生产更低,相信经过优化后将被广泛用于治疗肿瘤。
2.淋巴瘤
MD安德森肿瘤中心I/IIa期试验的结果显示,以CD19为靶点的脐带血来源的CAR-NK细胞疗法,在复发性/难治性非霍奇金淋巴瘤(NHL)患者和慢性淋巴细胞白血病(CLL)患者中显现出临床疗效,而且未观察到严重毒性反应。
该研究共入组11例患者,其中5例CLL患者,6例NHL患者,所有患者均接受最少3线和最多11线的先前治疗。8例患者(73%)获得缓解,其中7例(4例淋巴瘤,3例CLL)完全缓解,1例Richter’s转化成分缓解,但有持续性CLL。
在注射后30天内,所有剂量水平的反应都很迅速,注入的CAR-NK细胞扩增并维持在低水平至少12个月。另外,研究结果表明,CAR-NK细胞的使用与CRS、神经毒性或GVHD的发生无关,炎症细胞因子(包括IL-6)的水平也没有增加。
Fate Therapeutics公司近期公布异体iPSC衍生的CAR-NK细胞FT596的临床数据,FT596单药治疗表现出持久的肿瘤清除能力和延长的体内存活率,显示出iPSC衍生的NK细胞疗法成为新型癌症免疫疗法的开发前景。
此外,FT596在与利妥昔单抗联用时,与单独使用利妥昔单抗相比,FT596在体内显示出对CD20+淋巴瘤细胞杀伤的增强。这初步显示出,抗体药物与NK细胞治疗联合应用可以发挥协同效应,将会是CAR-NK细胞又一个开发新方向。
3.多发性骨髓瘤(MM)
MM是在B淋巴细胞分化成浆细胞的过程中发生的遗传突变导致的恶性肿瘤。MM细胞系中常见的肿瘤抗原有CS1、CD138、BCMA等。关于CAR-NK细胞产品治疗MM的研究相对较少。目前用于治疗MM的CAR-NK细胞产品多采用NK92细胞系,所采用的肿瘤抗原多为CS1和CD138。
细胞表面糖蛋白CD2子集1(CS1)是MM细胞表面高度表达的蛋白质,多参与MM细胞黏附和生长。CD138参与MM细胞的黏附、生长和成熟,是MM主要的诊断标记。体外研究已经证实,分别利用CS1和CD138为靶点设计的CS1-CAR-NK92细胞和CD138-IFNα-CAR-NK92细胞成功抑制MM细胞生长,延长了骨髓瘤小鼠的存活期。
CAR-NK用于治疗实体瘤的研究
CAR-T细胞在抗击实体肿瘤的过程中,会出现PD-1/PD-L1介导的免疫抑制。NK细胞表面PD-1表达很低,相对受肿瘤微环境免疫抑制小,也许是抗击实体瘤的良好候选者。
在实体瘤研究中,CAR-NK细胞的研究靶点多是靶向表达HER2、PSMA、mesothelin、ROBO1或MUC1等肿瘤相关抗原的转移性实体恶性肿瘤,例如前列腺癌、卵巢癌、胰腺癌和非小细胞肺癌。
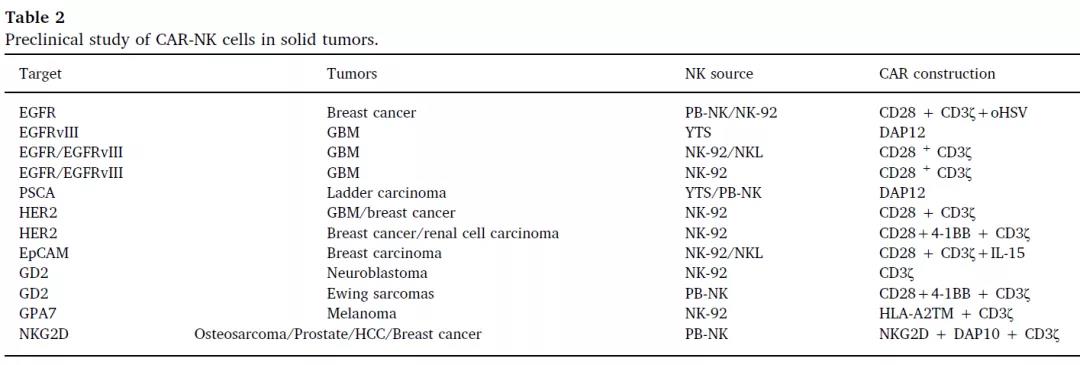
▲ CAR-NK细胞在实体中的瘤临床前研究
目前,CAR-NK针对实体瘤的治疗逐渐展开。
CAR-NK细胞的挑战
尽管CAR-NK细胞吸引了很多研究者的目光,其也存在一定问题。CAR-NK细胞作为一种治疗性癌症的成功实施目前受到三个主要因素的阻碍,即,(1)NK细胞对基因工程的抗性;(2)NK细胞的增殖潜力有限;(3)它们对输液的持久性有限。
NK细胞对基因工程的抗性挑战
病毒转导
从历史上看,逆转录病毒或慢病毒对原代NK细胞的病毒转导效率均较差。基于γ逆转录病毒的载体需要细胞积极增殖才能进入细胞。慢病毒的载体既可以感染循环细胞也可以感染非循环细胞,并携带较大的转基因,但由于其生存能力往往受到负面影响,因此它们在原代NK细胞中的效率也受到限制。
电穿孔
基因工程NK细胞的一种非病毒策略是通过DNA或mRNA质粒的电穿孔。DNA的电穿孔效率很低,且无法在DNA中稳定整合构建体。
转座子
目前正在研究的非病毒转导的一种替代方法是使用转座子。最常用的两种主要方法——piggyBac和睡美人(SB)转座子系统,目前正在临床测试基于SB的CAR载体。
SB最初来源于鱼类,但在人类基因组中仍保留其活性。它由两个部分组成:介导剪切和粘贴的SB转座酶和侧翼为末端反向重复序列(TIR)的DNA载体,转座酶可以与之结合以介导其几乎随机整合到基因组中。
这种方法可以转导长度大于100kb的基因,使其成为CAR整合的一个有吸引力的更高效率选择。转座子工程化的CAR-NK细胞是一种有前途的替代方法,可以在没有病毒整合的情况下实现稳定表达。
推荐阅读:创新技术持续提升!转座子系统助力“现货”CAR-NK细胞开发丨医麦新观察
CRISPR/Cas9
先前讨论的转导方法依赖于载体整合,而没有指定整合位点。必需存活基因或肿瘤抑制基因的整合和随后破坏的可能性对于临床产品可能是有害和危险的。与转录激活因子样效应核酸酶(TALEN)或锌指核酸酶(ZFN)等类似方法相比,CRISPR/Cas9系统的发现开启了高效靶向基因整合的可能性。
解决NK细胞的增殖潜力有限的挑战
1.基于细胞因子的扩增
基于细胞因子的扩增方案通常依赖于超生理水平来诱导原代NK细胞的扩增。
2、基于饲养层的扩增
基于饲养层的扩增方案将来自饲养层系统的受体介导的输入与细胞因子支持相结合,以促进原代NK细胞的大规模扩增。
解决NK体内扩增的挑战
来自过继细胞疗法(ACT)临床试验的证据通常无法在输注后1-2周内检测到输注NK细胞的存在。虽然NK细胞的短寿命有助于它们在ACT环境中的安全性,但它也显著缩小了治疗窗口。
小结
目前,全球正在进行的临床试验进行的荟萃分析确定了520项有效试验,共检查了64种不同的CAR,其中96.4%的试验使用CAR-T细胞。因此,就将实验室研究转化为临床环境而言,CAR-NK细胞领域仍处于起步阶段。
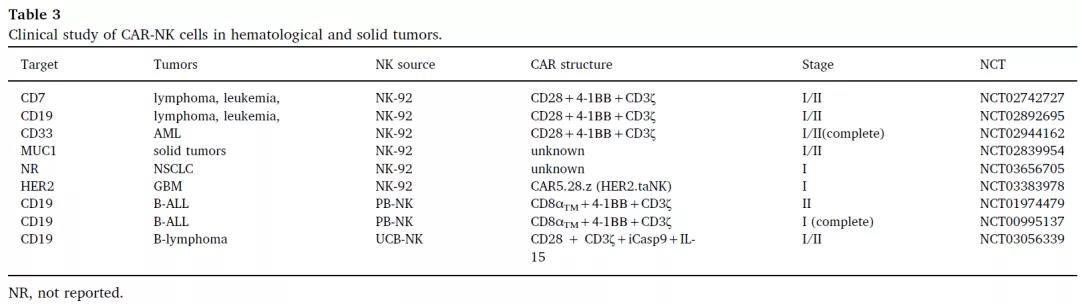
▲ CAR-NK细胞在血液瘤和实体瘤中的临床研究
随着CAR-NK细胞疗法的临床价值凸显,不管是赛诺菲、百时美施贵宝等制药巨头还是Catamaran Bio、Artiva Bio等生物技术初创公司都相继布局CAR-NK赛道。显而易见,CAR-NK已成为继CAR-T之后最引人关注的工程细胞疗法。
近些年随着对NK的细胞生物学,免疫学,以及记忆性NK细胞的研究和认识越来越深入以及对于NK细胞的免疫相关受体的信号通路等新的研究.。越来越多的研究为NK细胞在免疫治疗中的应用奠定了良好的基础,相信随着理论知识的更加完善,临床研究的进行,以及对当前CAR-NK细胞面临挑战的攻克,CAR-NK细胞疗法也许会为肿瘤免疫治疗带来革命性进展,CAR-NK细胞的治疗方法在今后也能占据一方舞台。


